胡荣康博士近期在国际知名期刊《International Journal of Biological Macromolecules》(IF=7.7,中科院一区TOP期刊)上发表了题为“Increasing the flexibility of the substrate binding pocket of Streptomyces phospholipase D can enhance its catalytic efficiency in soybean phosphatidylcholine”的研究论文,安徽师范大学为第一完成单位,胡荣康博士为论文第一/通讯作者。
磷脂酶D(EC 3.1.4.4)是一种普遍存在于生物体内的酶,可催化磷脂头部极性基团的转移反应,从而将自然界中含量丰富的磷脂酰胆碱(PC)催化合成其他稀有磷脂。大豆PC是天然磷脂的主要来源,是工业上应用最广泛的磷脂类型。然而,受限于提取和纯化工艺,大豆PC通常是由不同长度脂肪酸链组成的混合物。由于脂肪酸取代基的类型影响磷脂分子的结构多样性,这将导致磷脂酶D针对某些PC分子具有底物特异性,从而限制了磷脂酶D在大豆PC加工中的应用。考虑到大豆PC脂肪酸链组成复杂,通过分子修饰磷脂酶D以催化具有特定脂肪酸链长的PC不利于其工业应用。此外,许多报道指出改变磷脂酶D的底物特异性往往伴随着酶活性的降低。因此,为了使磷脂酶D高效催化大豆PC,必须提高磷脂酶D对不同脂肪酸链长的PC的催化活性。
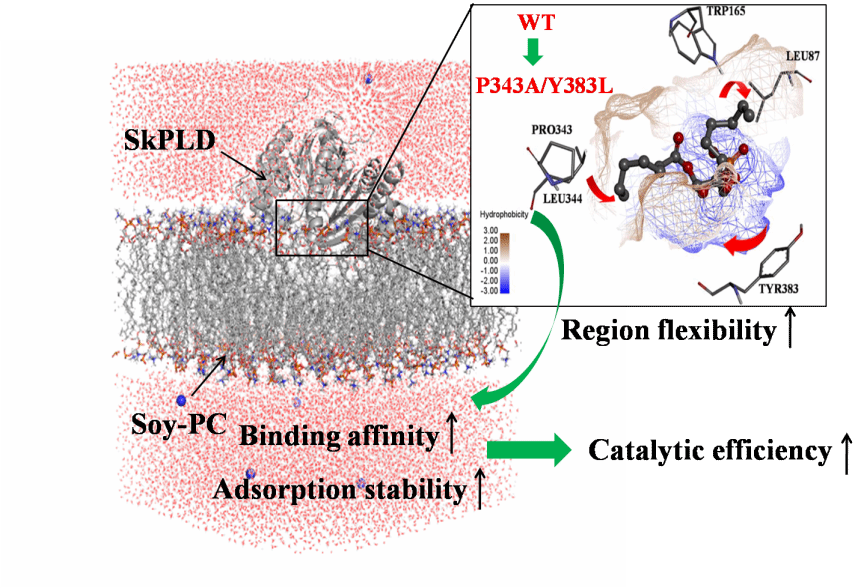
在这篇报道中,作者研究了底物结合袋的区域柔性对链霉菌磷脂酶D催化大豆PC的影响。前沿分子轨道表明底物磷脂的疏水性脂肪酸尾部干预磷脂酶D的催化过程。基于HOMO-LUMO能隙和静电电位数据发现短脂肪酸链的PC相较于中和长脂肪酸链的PC具有更强的反应性,这解释了为什么磷脂酶D通常对短脂肪酸链的PC有更高的催化活性。通过调整底物结合口袋疏水性和空腔体积的组合策略,提高了底物结合口袋的区域柔性,减少了链霉菌磷脂酶D对不同脂肪酸链长PC分子的选择性差异,增加了底物亲和力。此外,单分子层实验证实增强底物结合口袋的区域柔性能够降低酶与大豆PC分子结合的能垒,使酶可以很容易地扩散和穿透大豆PC单层膜,其底物结合口袋中的非极性氨基酸可以快速与磷脂的脂肪酸链相互作用,从而增强酶的催化活性。这些发现有助于促进链霉菌磷脂酶D作为大豆PC的工业催化剂的发展进程。
本研究工作得到安徽省高校科学研究重点项目、安徽省高校优秀科研创新团队项目等课题的资助。
论文链接:https://doi.org/10.1016/j.ijbiomac.2024.135824

